המאמר נכתב ע"י ד"ר אלכסנדר יוסים, (יו"ר לשעבר של החברה הישראלית להשתלות) ופרופ' איתן מור (מנהל מרכז השתלות, המחלקה לכירורגיה ב', מרכז רפואי שיבא, תל השומר, רמת גן; מסונף לפקולטה לרפואה סאקלר, אוניברסיטת תל אביב).
המאמר פורסם ב- הרפואה ב-30.11.2023.
תקציר
תחום השתלות האיברים החל את צעדיו באמצע המאה הקודמת והתפתח במקביל להכנסת שיטות ניתוח חדשנית, התקדמות בהבנה של תהליכים אימונולוגיים הגורמים לדחיית השתל, הכנסת תרופות למניעת דחייה ושיפור בשימור איברים.השתלת לב והשתלת כליה בוצעו לראשונה בישראל כבר באמצע שנות ה־ 60 של המאה העשרים. בהמשך, בסוף שנות ה־ 80 ותחילת ה־ 90 בוצעו לראשונה גם השתלת לבלב־כליה, השתלת ריאות והשתלת כבד. השינוי המשמעותי שהביא להגדלת מספר ההשתלות ושיפור בשיעורי הצלחה אירע עם הכנסתם לטיפול של הדור החדש של התרופות למניעת דחייה, הציקלוספורין ובהמשך הפרוגרף. ציון דרך נוסף בישראל הוא הקמתו של המרכז הלאומי להשתלות בשנת 1994 שהביא לריכוזיות נושא ההשתלות כולל: הסדרת רשימות ארציות של מועמדים להשתלה לכל איבר ואיבר, הקמת ועדות מקצועיות הקובעות מדיניות הקצאת האיברים והקמת ועדה אתית ממשלתית לפיקוח על ביצוען של השתלות מתורם
חי.
בשנת 2008 , כחודש לפני חתימת אמנת איסטנבול, נחקק חוק ההשתלות להסדרת נושא ההשתלות בישראל ובו נכללו סעיפים להגבלת הסחר באיברים ברוח אמנת איסטנבול. צעדים אלו הגדילו את מספר ההשתלות המבוצעות בישראל והפחיתו משמעותית את מספר ההשתלות של ישראלים בחו״ל.
הקמתה של עמותת מתנת חיים בשנת 2012 היא ציון דרך נוסף שהביא לעלייה משמעותית במספר השתלות הכליה, שחלקם הגדול מבוצע כיום מתרומות אלטרואיסטיות. למרות זאת, גם כיום קיימת מצוקת איברים להשתלה מנפטר, ועדיין ארוכה הדרך לסגירת הפער בין ההיצע והצורך של איברים להשתלה.
בסקירה זו מצוינות פריצות הדרך בביצוע ההשתלות שבוצעו לראשונה בישראל, ומצוינים הצעדים שנעשו להגדלת מספר ההשתלות. במקביל, מפורטים החוקים והנהלים להסדרת הקצאת האיברים בישראל.
הקדמה
התקופה החלוצית של השתלות בישראל התקיימה משנות ה־ 60 ועד שנות ה־ 90 של המאה העשרים. תקופה זו נפתחה עם השתלת הכליה הראשונה מתורם מן החי, שובצה על ידי פרופ׳ מוריס לוי ופרופ׳ יוסף רוזנפלד בבית חולים בילינסון בשנת 1964 – עשור לאחר השתלת הכליה הראשונה שבוצעה בבוסטון, ארה״ב. השתלת הכליה הראשונה מתורם נפטר בוצעה לראשונה בישראל בקריה הרפואית רמב״ם בשנת 1967, על ידי פרופ׳ דוד ארליך ופרופ׳ אורי בתר. בחודש דצמבר 1968, כשנה לאחר השתלת הלב הראשונה שבוצעה ביוהנסבורג, דרום אפריקה, ביצע פרופ׳ מוריס לוי את השתלת הלב הראשונה בישראל. הלב היה של קורבן תאונת עבודה בן 35, שהושתל בחזהו של חולה בן 41 [1]. המושתל שרד למשך שבועיים, אך הניתוח עורר סערה לאחר שהתרומה נלקחה ללא ידיעת המשפחה, בהסתמך על חוק האנטומיה והפתולוגיה שהתיר לעשות שימוש בחלק מן הגופה או באיבר מן המת, למען ריפויו של אדם – אף ללא נטילת רשות וקבלת הסכמה מצד משפחת הנפטר [2].
לבתי החולים שעסקו באותן שנים בביצוע השתלות כליה הצטרפו בתי חולים נוספים, קטנים כגדולים. כך, לדוגמה, בבית חולים הלל יפה בוצעו 35 השתלות עד שנת 1976 על ידי פרופ׳ ארווין יעקב שהשתלם בארה״ב אצל פרופ׳ תומאס סטרזל – מהאבות המייסדים של מקצוע ההשתלות בעולם. בשנה זו עבר הצוות שאיתו להמשיך את פעילות ההשתלות במרכז הרפואי שיבא שבוצעו בו עוד כ־ 40 השתלות עד לתחילת שנות ה־ 80 . במקביל, בבית חולים השרון עד לשנת 1974, נעשו 14 השתלות כליה על ידי ד׳׳ר דוד קמחי, ובבית החולים הדסה בירושלים בוצעו באותן שנים כ־ 30 השתלות על ידי פרופ׳ אריה דורסט – אף הוא היה תלמידו של פרופ׳ סטרזל. כיום פועלות בישראל שש תוכניות מורשות להשתלת איברים: המרכז הרפואי הדסה בירושלים, במרכז הרפואי שיבא־תל השומר, במרכז הרפואי רבין, בבית החולים שניידר לילדים, במרכז הרפואי האוניברסיטאי סורוקה־רמב״ם – הקריה הרפואית לבריאות האדם, ובמרכז הרפואי תל אביב־סוראסקי.
בשנות ה־60 וה־70 של המאה העשרים הרבה מההשתלות נכשלו והסתיימו במות המושתל, בין היתר מאחר שבאותה תקופה לא היה מידע מספיק בהתאמת הכליה בין תורם למקבל, והטיפול נוגד דחייה היה מבוסס על מתן סטרואידים ואזאטיופרין (אימורן) בלבד. מצב זה הביא לשיעורי דחייה גבוהים ולשיעור הישרדות קצר של שתלי הכליה. בסוף שנות ה־70 נוסף הנסיוב האנטי־טימוציטרי (ATG) והחל משנת 1980 הוכנסה לטיפול תרופה חדשה – ציקלוספורין – תרופה שהפחיתה באופן משמעותי את שיעור הדחייה לאחר השתלת כליה. ציקלוספורין הביא להארכת חיי השתל [4,3] ואפשר את השתלתם של איברים טמומים (סולידיים) נוספים כולל: לב, ריאות, כבד ולבלב [5].
בשנות ה־80 עבר משקל הכובד בביצוען של השתלות בישראל לבית חולים בילינסון, שבו הוקמה מחלקת השתלות איברים ייחודית בניהולו של פרופ׳ זכי שפירא. הוא נעזר בצוות של שני אורולוגים (ד״ר יוסים וד״ר שמואלי), שני כירורגים (ד״ר שהרבני וד״ר נקש) ונפרולוג (ד״ר לוסטיג), שהשקיעו את כל עבודתם ומרצם בביצוען של השתלות איברים. באותה תקופה, השתלות בארץ, שעיקרן היו השתלות כליה, התבצעו ללא תיאום מרכזי, כאשר כל מרכז היה אחראי לאתר, לקצור, לשמור, לבדוק ולהשתיל את האיבר. הנצלת האיברים להשתלה נעשתה מכוח חוק אנטומיה ופתולוגיה משנת 1953 המוזכר לעיל [2]. בשנת 1978 הוקמה אגודת אדי שמטרתה הייתה להגדיל את מספר תרומות האיברים מהנפטר ע״י עידוד החתימה על כרטיס תורם איברים. האגודה הייתה מיזם של בני משפחתו של אדי – אהוד בן־דרור, שהמתין זמן רב להשתלת כליה, ונפטר לאחר ההשתלה בשל מצבו הקשה לאחר ההמתנה הממושכת להשתלה.
עם השנים הפך כרטיס אדי לכרטיס התורם הרשמי בישראל ומאגר החתומים על הכרטיס מנוהל כיום על ידי המרכז הלאומי להשתלות. בשנת 1980 הוכנסו תיקונים לחוק האנטומיה והפתולוגיה, שאפשרו לאדם, טרם פטירתו, או למשפחתו, להתנגד לתרומת איברים. ציון דרך נוסף שאפשר השתלות לב ופתח דלת להשתלת איברים אחרים הוא הקביעה של מועצת הרבנות הראשית, משנת 1987, שניתן לעשות שימוש בליבו של הנפטר בתנאי שיוכח שהייתה הפסקה של מערכת הנשימה, ובתנאי
שנציג הרבנות ישתתף ויאשר כי קביעת המוות נעשתה על פי ההלכה [6].
במקביל להכנסת הטיפול בציקלוספורין בישראל, הוכנסה בבית החולים בילינסון במסגרת הטיפול גם בדיקה ציטולוגית באמצעותה FNA לאבחון דחייה על ידי ד״ר אלכס יוסים. ואכן בביצוען של מעל 3,000 בדיקות כאלו לא נצפה סיבוך משמעותי [7]. כל אלו הביאו לשיפור של עשרות אחוזים בהישרדות שתל הכליה. הכנסת הציקלוספורין כתרופה נוגדת דחייה אפשרה גם
את השתלתם של איברי בטן ובית חזה, וכך בוצעה בשנת 1989 לראשונה השתלת לבלב משולבת בכליה על ידי פרופ׳ רישרד נקש, ובשנת 1989 בוצעה השתלת הכבד הראשונה על ידי ד״ר יגאל קם בבית החולים רמב״ם. החולה נפטרה לאחר ההשתלה וד״ר קם חזר לארה״ב כדי לנהל את תוכנית השתלות הכבד בדנוור־קולורדו במקומו של ד״ר סטרזל שעבר לפיטסבורג. השתלת הכבד המוצלחת הראשונה בישראל בוצעה בהמשך על ידי ד״ר אחמד עיד בביה״ח הדסה עין כרם בשנת 1992. באותה שנה בוצעה גם השתלת הריאות הראשונה על ידי פרופ׳ ג׳ו בורמן, בבית החולים הדסה עין כרם.
הקמת המרכז הלאומי להשתלות ויוזמות חקיקה בתחום ההשתלות
ציוני דרך חשובים נוספים היו הקמתה של החברה הישראלית להשתלות בשנת 1991. בראש החברה עמדו במהלך השנים ד״ר אלכס יוסים, פרופ׳ יעקב לביא, פרופ׳ סולי מזרחי ופרופ׳ איתן מור, וד״ר רותי רחמימוב ארגנה כנסים מקצועיים בינלאומיים, הציגה להסתדרות הרפואית תוכנית התמחות במקצוע ההשתלות, השמיעה בקול ברור את דעתה בתחומי האתיקה בנושא סחר באיברים ועודדה פרסום מאמרים מדעים בעיתונות המקצועית.
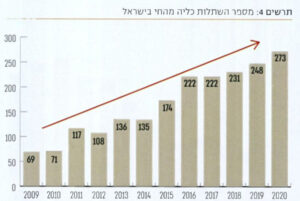
1). המרכז הלאומי קובע נהלים להקצאת איברים, מרכז את רשימות המועמדים להשתלה של כל בתי החולים
בארץ, ועוסק בהקצאת האיברים בהתאם להנחיות שנקבעו בוועדות המקצועיות של כל איבר ואיבר ואושררו בוועדת ההיגוי. כל זאת בנוסף להכשרת מתאמות תרומת איברים, חינוך והסברה וקידום תחום ההשתלות וכן בניית שיתופי פעולה עם מדינות אירופה. ועדת ההיגוי של המרכז הורכבה בתחילה מיו״ר וחברי ועדה שכללו את נציגי מרכזי ההשתלה. רק בהמשך נוספו לוועדת ההיגוי משפטן, נציג מושתלים פסיכולוגית ונציג דת. יו״ר הראשון של ועדת ההיגוי במרכז הלאומי להשתלות היה פרופ׳ עמי ברזילי, לאחריו כיהנו פרופ׳ גבי ברבש, פרופ׳ יונתן הלוי ופרופ׳ גבי גורמן, וכיום מכהן בתפקיד פרופ׳ רפי ביאר.
ציוני דרך משמעותיים ברמה החוקתית והאתית הם צעדי החקיקה בכנסת של חוק השתלות האיברים [8] והחוק לקביעת מוות מוחי־נשימתי [9] וכן החתימה של נציגי ישראל על האמנה הבינלאומית "אמנת איסטנבול", האוסרת על סחר באיברים [10]. כל הצעדים הללו הגיעו לאחר תקופה ממושכת של "תיירות השתלות" של ישראלים ברחבי העולם, פעילות המנצלת עד היום
אוכלוסיות של תורמים ופועלת באמצעות מתווכי איברים. פעילות זו פגעה משמעותית בביצוען של השתלות בישראל והביאה לנזק משמעותי לתדמיתה, שבא לידי ביטוי בכנסים ובפורומים המקצועיים הבינלאומיים [11]. ואכן, השינוי בעקבות חוק ההשתלות הביא מיידית לירידה של תיירות ההשתלות ובמקביל עלייה במספר ההשתלות המבוצעות בישראל [12].
חוק ההשתלות מגדיר במדויק מהו סחר באיברים וקובע עונש של שלוש שנות מאסר בעוון תיווך של איבר להשתלה, בין אם נעשה הדבר בתוך גבולות המדינה ובין אם מחוצה לה ואוסר במפורש על גופי הביטוח, כולל קופות החולים והביטוחים הפרטיים, לממן ניתוחי השתלה בכל מדינה שבה מתבצע הניתוח בניגוד לחוק באותה המדינה או אם נקשר בסחר באיבר כמוגדר בחוק. מיד לאחר חקיקת החוק הועברו ההנחיות המתחייבות ממנו לכל חברות הביטוח וקופות החולים, ומימון השתלות
האיברים הבלתי חוקיות מחוץ לישראל פסק. הפסקת מימון זה עצרה באחת את תופעת תיירות ההשתלות מישראל ליעדים שבהם התקיים סחר באיברים. חוק למניעת סחר באיברים זכה לתשבחות בינלאומיות רבות, ושב ומועלה על נס בפורומים בעולם העוסקים בתחום כאות ומופת להתגייסות מדינה למניעת סחר באיברים. ממובילי מאבק בינלאומי זה יש לציין את פועלו של פרופ׳ יעקב לביא המשמש כחבר בגוף הבינלאומי בעניין זה.
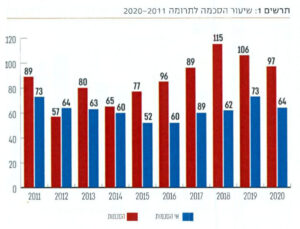
במקביל לאיסור סחר באיברים ותיירות השתלות בלתי חוקית, מכיל החוק סעיפים ייחודיים שנועדו להגדיל את מספר תרומות האיברים להשתלה מתורמים חיים ומנפטרים. כך, לדוגמה, נקבע נוהל הוועדות לאישורן של השתלות מתורם חי וכן נקבעו הטבות להסרת חסמים כלכליים המהווים לעיתים מכשול לתרומות אלה, על ידי מתן החזר כספי בגין אובדן ימי עבודה והוצאות נסיעה, והטבות בביטוח בריאות. בעקבות צעדים אלה עלה מספר ההשתלות המבוצעות בישראל באופן משמעותי. החוק השני שהתקבל בשנת 2008 באותה ישיבה בכנסת, הוא חוק המוות המוחי־נשימתי מסדיר את אופן קביעתו של המוות המוחי [9]. בחוק נקבע, כי שעת הפטירה תקבע לפי שעת המוות המוחי־נשימתי, וכי מוות מוחי־נשימתי יקבע על ידי שני רופאים מוסמכים, שלא טיפלו בחולה ולא ייצגו אינטרסים של חולה אחר הזקוק להשתלה. קביעת המוות תיעשה על־פי פרמטרים ידועים: היעדר
לחץ דם, היעדר נשימה עצמאית והיעדר תגובה של אישונים ורפלקסים נוספים; ובנוסף, הפסקת פעילות המוח תקבע באמצעות בדיקה במכשירים אובייקטיביים. תוספת לחוק ההשתלות, הוא"התעדוף" שניתן לחתומים על כרטיס תורם, תכנית שהגה פרופ׳ יעקב לביא. לפי תוכנית זו קיימת גם הגנה על מי שתרם כליה והגיע למצב של אי ספיקת כליות, שיקודם לראש התור להשתלה [13].
חידושים בשיטות הניתוח ובטיפול התרופתי למניעת דחייה
עם התקדמות בהשתלת איברים ברחבי העולם, תוכניות ההשתלה בארץ הגדילו את פעילותן והוכנסו לשימוש גם מגוון ניתוחי השתלה חדשניים. כך, בוצעו לראשונה בישראל השתלת אונת כבד בילד (1996), השתלת אונת כבד במבוגר (2002), שילוב של השתלת כליה ואונת כבד מאותו תורם (2012) [14], על ידי פרופ׳ איתן מור, והשתלת מעי במבוגר (2014 ) על ידי ד״ר אביתר נשר.
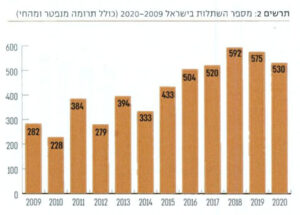
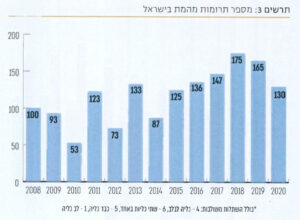
לאחרונה, בזכות שיתוף פעולה בין המרכז הלאומי להשתלות עם צ׳כיה הוחל בביצוען של השתלות מוצלבות מעבר לים. אחד מהגורמים החשובים להגדלת מספר השתלות הכליה מהחי הוא פועלו של הרב ישעיהו הבר ז״ל, יו״ר עמותת "מתנת חיים", שעודד ויזם תרומות של כליות על בסיס אלטרואיסטי לחולים הממתינים להשתלה. כיום, מאגר התורמים האלטרואיסטים שתרמו כליה עבר 1,200 תרומות ושיעורו 60% מכלל השתלות הכליה השנתי. מפעל שאין שני לו בעולם הממשיך בפעילותו גם לאחר פטירתו המצערת של הרב מנגיף הקורונה בשנת 2019.
המעקב אחר מושתלי איברים הפך להיות למקצוע בפני עצמו הדורש ידע וניסיון בטיפול בדחיה, זיהומים ובעיות אחרות המאפיינות את אוכלוסיית המושתלים. כיום קימת תת־מומחיות בכל אחד מהתחומים של נפרולוגיה, ריאות, לב וכבד להכשרת הרופאים המטפלים בחולים המושתלים לאחר השתלה במסגרת מרפאות מעקב הפועלות בכל מרכזי ההשתלה בישראל.
א. מגמות לעתיד
פריצת דרך חשובה לקראת אפשרות השתלה ללא טיפול תרופתי לאחריה הן השתלות משולבות של כליה עם תאים שמקורם בלשד העצם. השתלה ראשונה מסוג זה בוצעה בשנת 2018 בבילינסון על פי פרוטוקול של מרכז ההשתלות בסטנפורד [19]. אולם השתלה מסוג זה מתאימה רק למקרים נדירים של התאמה אנטיגנית מלאה. כיום מתבצעים מחקרים להרחבת השימוש
בשיטה זו על ידי השתלת תאי דם ממקור לשד העצם של התורם מסוג תאים רגולטוריים, שתתאים לחולים גם ללא התאמה אנטיגנית מלאה [20]. הפעילות בתחום ההשתלות קידמה תחומים רפואיים המהווים ממשקים לתחום ההשתלות כמו הכירורגיה של הכבד, רפואת עור למושתלים ואימונולוגיה של השתלות. תחום ההשתלות נמצא כיום בהתפתחות לקראת עידן חדש שבו יוכנסו לשימוש מכונות לשימור איברים שיביאו לשיפור איכות האיברים להשתלה ולהארכת זמן השימור [21], תתפתח רפואה מותאמת אישית על ידי שימוש בביומרקרים, לניטור בלתי חודרני לאבחנה של דחייה [22] ויוכנסו לשימוש טכנולוגיות של הנדסת איברים שיגדילו את מאגר האיברים להשתלה [23]. תחום נוסף שהגיע לאחרונה לתקשורת הוא השתלה של איברי חזיר (לב וכליה) מהונדסים גנטית לשאת חלבונים אנושיים כדי למנוע דחייה מיידית של השתל. למרות ההצלחה בניסוי החד, נותרו עוד מהמורות רבות כדי להביא ליישומה של טכנולוגיה זו לצרכים רפואיים [24].
לסיכום
תחום השתלות האיברים בישראל חווה התקדמות משמעותית ב־ 50 השנים האחרונות, אך קיים עדיין מחסור בתרומות מנפטר. אנו תקווה שבאמצעות השקעה בפעילויות הסברה וחינוך, יצומצם הפער בין הביקוש להיצע האיברים להשתלה, ובמקביל יוכנסו חידושים טכנולוגיים שיביאו להארכת חיי האיבר המושתל.
מחבר מכותב: פרופ׳ איתן מור, מרכז השתלות, המחלקה לכירורגיה ב׳ מרכז רפואי שיבא, דרך שיבא 2 רמת גן
דוא"ל: Eytan.mor@sheba.health.gov.il
ביבליוגרפיה
1.The first heart transplant in Israel 1968 https://www.haaretz.co.il/news/health/1.1366768
2. חוק האנטומיה והפתולוגיה תשי״ג https://www.health.gov.il/LegislationLibrary/Patolog_01.pdf
3. R. Y. Caine, K. Rolles, and D. J. G. White, Cyclosporin A initially as the only immunosuppressant in 34
recipients of cadaveric organs: 32 kidneys, 2 pancreases, and 2 livers, The Lancet, 1979; 2: 1033-1036.
4. Starzl TE, Weil R III, Iwatsuki S, Klintmalm G, Schroter GPJ, Koep LJ, Iwaki Y, Terasaki PI, Porter KA. The use of cyclosporin A and prednisone in cadaver kidney transplantation. Surg Gynecol Obstet 1980; 151:17-26.
5. Thomas E. Starzl, M.D., Ph.D., Goran B. G. Klintmalm, M.D., Kendrick A. Porter, M.D., Shunzaburo Iwatsuki, M.D., and Gerhard P. J. Schroter. Liver transplantation with use of Cyclosporine A and prednisone.
N Engl J Med. 1981; 305: 266-269.
6. פסיקת הרבנות הראשית התשמ״ז: http://www.daat.ac.il/he-il/refua/author/yud/yisraeli/yisraeli-hashtala.htm
7. Yussim A, Shapira Z, Nakache R, et al. The utility of fine-needle aspiration biopsy in organ transplantation. Transplant Proc. 1992; 24:1880-1881
8. Israel Transplant Law 2008: https://health.gov.il/LegislationLibrary/Hashtala_01.pdf
9. Israel Brain Death Law 2008: https://www.health.gov.il/LegislationLibrary/Patolog_03.pdf
10. Declaration of Istanbul 2008: Clin J Am Soc Nephrol. 2008;3:1227-31.
11. Mor E. Changes in the transplantation world-from altruism to utilitarian approach. Harefuah. 2006; 145:746-8.
12. Ashkenazi T, Rahamimov R, Elhalel MD, Cohen J, Mor E. Effect of a legal initiative on deceased- and living-donor kidney transplantation in Israel. Transplant Proc. 2013;45:1301-2.
13. LaveeJ, Ashkenazi T, Gurman G, Steinberg D. A new law for allocation of donor organs in Israel. Lancet 2010; 375:1131- 1133.
14. E. Mor, E. Nesher, Z. Ben-Ari et al, Sequential liver and kidney transplantation from a single living donor in two young adults with primary hyperoxaluria type-1. Liver Transplantation 2013;19:646-8.
15. Summers DM, Pettigrew GJ. Kidney transplantation following uncontrolled donation after circulatory death. Curr Opin Organ Transplant. 2020;25:144-150.
16. A Szold, J MKlausner, R Nakache. Laparoscopic donor nephrectomy: initial experience in Israel Harefuah 1999 ;136: 917-9.
17. Eizner S, Orlin J, Nesher E, Mazhybovsky V, Gurevich M, Michowiz R, Rahamimov R and Mor E. ABO incompatible kidney transplantation. Harefuah 2017;156:237-241.
18. Israel Pair Exchange Program: https://www.health.gov.il/Subjects/Organ_transplant/live_donors/Pages/intersection_plan.aspx
19. John D. Scandling, Stephan Busque, Sussan Dejbakhsh-Jones, Claudia Benike, Maria T. Millan, et al Tolerance and Chimerism after Renal and Hematopoietic-Cell Transplantation. N Engl J Med 2008; 358:362-8.
20. RoemhildA, Otto NM, Moll G, Abou-El-Enein M, Kaiser D, Bold G, et al. Regulatory T cells in kidney disease and transplantation. Kidney Int. 2016 ;90:502-14.
21. Bellini MI, Nozdrin M, Yiu J, Papalois V. Machine Perfusion for Abdominal Organ Preservation: A Systematic Review of Kidney and Liver Human Grafts. J Clin Med2019 Aug 15;8:1221.
22. Sarwal MM, Benjamin J, Butte AJ, Davis MM, WoodK, Chapman J. Transplantomics and biomarkers in organ transplantation: a report from the first international conference. Transplantation. 2011;91:379-82.
23. Joshua Hunsberger, Josh Neubert, Jason A. Wertheim, Julie Allickson & Anthony Atala Bioengineering Priorities on a Path to Ending Organ Shortage. Current Stem Cell Reports 2016; 2,: 118-127.
24. Avneesh K. Singh, Corbin E. Goerlich, Aakash M. Shah, Tianshu Zhang, Ivan Tatarov, David Ayares, et al. Cardiac Xenotransplantation: Progress in Preclinical Models and Prospects for Clinical Translation. Transpl Int, 2022; 35:10171.